Της Νεφέλης Στούπα,
Οι περισσότεροι από εμάς διαθέτουμε περίπου 20.000 με 25.000 γονίδια, των οποίων τα προιόντα έκφρασης έχουν καθοριστικό ρόλο στη διαμόρφωση της εξωτερικής μας εμφάνισης, στη φυσιολογία των συστημάτων μας, όπως και σε διάφορα άλλα στοιχεία που καθορίζουν τα φαινοτυπικά μας χαρακτηριστικά. Ταυτόχρονα, όμως, υπάρχει τεράστιος αριθμός ασθενειών που οφείλονται μονάχα σε ένα ελαττωματικό γονίδιο. Δηλαδή, μονάχα μια μετάλλαξη, όπως η αντικατάσταση ενός νουκλεοτιδίου (παρουσία διαφορετικής αζωτούχας βάσης) στην αλληλουχία του DNA, οδηγεί σε ελαττωματικό προϊόν έκφρασης του γονιδίου. Το ελαττωματικό προϊόν επηρεάζει τη λειτουργία ή ακόμη και τη δομή του κυττάρου και κατ’ επέκταση μπορεί να έχει σοβαρές συνέπειες για τον ίδιο τον οργανισμό.
Χαρακτηριστικό παράδειγμα γενετικής ασθένειας που προκαλείται από μονάχα μια αλλαγή στην αλληλουχία του DNA είναι η δρεπανοκυτταρική αναιμία. Η μεταλλαγμένη αιμοσφαιρίνη HbS, που εμφανίζεται στα άτομα που πάσχουν, είναι αποτέλεσμα μιας γονιδιακής μετάλλαξης στην τριπλέτα που κωδικοποιεί το γλουταμινικό οξύ. Στην κωδική αλυσίδα του DNA αλλάζει μία βάση και το φυσιολογικό κωδικόνιο GAG, που κωδικοποιεί το γλουταμινικό οξύ, αντικαθίσταται από το GTG, που κωδικοποιεί το αμινοξύ βαλίνη. Αυτή η μετάλλαξη οδηγεί σε αλλαγή της στερεοδιάταξης της αιμοσφαιρίνης, η οποία έχει ως αποτέλεσμα την αλλαγή της μορφής των ερυθροκυττάρων, τα οποία, σε συνθήκες έλλειψης οξυγόνου, παίρνουν χαρακτηριστικό δρεπανοειδές σχήμα. Δηλαδή, η αντικατάσταση μονάχα μιας βάσης (η αντικατάσταση αδενίνης από θυμίνη) οδηγεί σε μια πολύ σοβαρή παθολογική κατάσταση. Εύλογα προκύπτει το ερώτημα, λοιπόν, τι θα μπορούσε να συμβεί αν γινόταν επιδιόρθωση αυτού του ελαττωματικού γονιδίου;
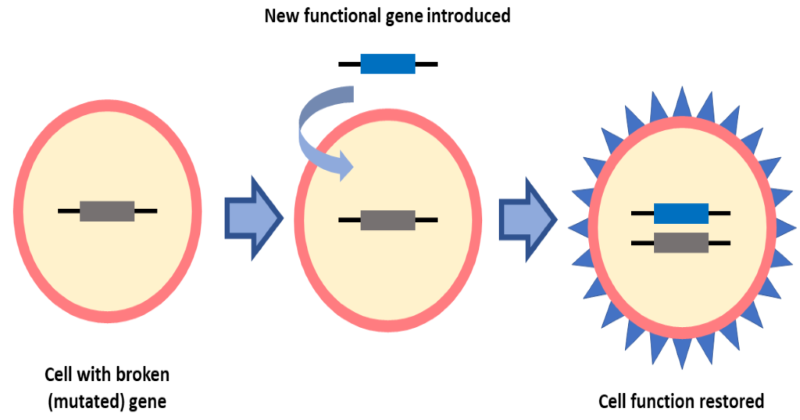
Σε περίπτωση που γίνει αντικατάσταση του ελαττωματικού γονιδίου από ένα φυσιολογικό αλληλόμορφο σε κάποιο ερυθροκύτταρο, το ερυθροκύτταρο που προκύπτει είναι φυσιολογικό (έχει φυσιολογικό σχήμα και παράγει φυσιολογική αιμοσφαιρίνη) και σε περίπτωση που γίνει αντικατάσταση του ελαττωματικού γονιδίου σε όλα τα ερυθροκύτταρα, πλέον δεν εμφανίζονται τα συμπτώματα της αναιμίας και ο ασθενής έχει θεραπευτεί. Τέτοιοι δραστικοί τρόποι επίλυσης γενετικών ανωμαλιών που αφορούν παρέμβαση σε γονιδιακό επίπεδο συναποτελούν τη γονιδιακή θεραπεία. Η γονιδιακή θεραπεία, δηλαδή, είναι μια ιατρική προσέγγιση που αντιμετωπίζει ή προλαμβάνει την ασθένεια διορθώνοντας το υποκείμενο γενετικό πρόβλημα. Οι τεχνικές γονιδιακής θεραπείας επιτρέπουν τη θεραπεία μιας διαταραχής αλλάζοντας τη γενετική σύνθεση ενός ατόμου, αντί να χρησιμοποιούν φάρμακα ή χειρουργική επέμβαση.
Αν και η θεραπευτική αυτή επιλογή είχε υποστεί σκεπτικισμό, όταν επισημάνθηκε για πρώτη φορά τη δεκαετία του 1970, η βάση της, δηλαδή η αντικατάσταση ή διόρθωση ενός προβληματικού γονιδίου, αποδείχθηκε τελικά σωστή. Οι γονιδιακές θεραπείες που εφαρμόζονται στη σύγχρονη εποχή βασίζονται σε δύο προσεγγίσεις. Η πρώτη (και συχνότερη) περιλαμβάνει τη λήψη αίματος από έναν ασθενή και στη συνέχεια πραγματοποιείται η τροποποίηση συγκεκριμένων κυττάρων στο εργαστήριο πριν την επανεισαγωγή τους στον ασθενή (ex vivo μέθοδος). Η δεύτερη προσέγγιση περιλαμβάνει τη χορήγηση των γονιδιακών θεραπειών απευθείας στον οργανισμό, συνήθως σε εύκολα προσβάσιμες περιοχές, όπως οι οφθαλμοί (in vivo μέθοδος).
Πλέον, βέβαια, οι γονιδιακές θεραπείες έχουν εξελιχθεί και σήμερα εξετάζουμε και άλλες προσεγγίσεις. Οι θεραπείες αυτές έχουν γίνει πιο ασφαλείς και αποτελεσματικές, ενώ μπορούν να αντιμετωπίσουν και παθήσεις σε άλλα όργανα, όπως την καρδιά ή το ήπαρ. Μερικές θεραπείες έχουν ξεφύγει μάλιστα από τον κλασικό ορισμό της γονιδιακής θεραπείας και αξιοποιούν μοριακά εργαλεία, για να επιδιορθώσουν τα λάθη στα υπάρχοντα γονίδια, αντί να εισαγάγουν ένα νέο γονίδιο.
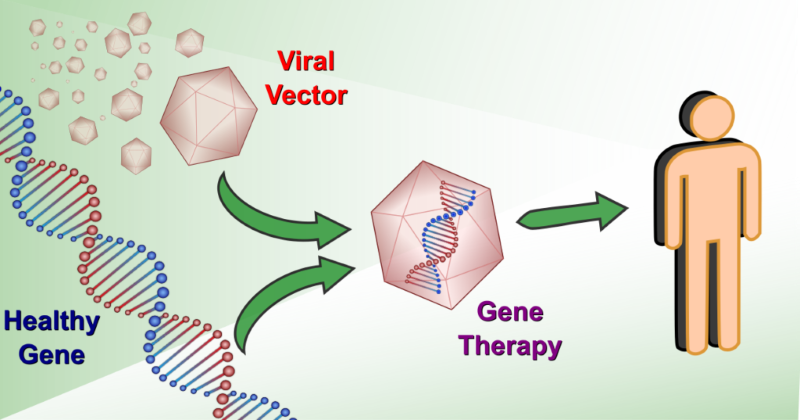
Η πρώτη εφαρμογή γονιδιακής θεραπείας στηρίχθηκε στη θεωρία ότι «όταν μία νόσος αποδίδεται σε ένα παθολογικό γονίδιο, χορηγούμε στον ασθενή ένα λειτουργικό αντίγραφο του γονιδίου αυτού» και πραγματοποιήθηκε το 1990, όταν επιστήμονες από το National Institutes of Health των Η.Π.Α. χορήγησαν γονιδιακές θεραπείες σε δύο νεαρά κορίτσια με σύνδρομο σοβαρής ανοσοανεπάρκειας που συνδέεται με την απουσία ενός ενζύμου. Στην προαναφερθείσα κλινική δοκιμή, τα θεραπευτικά γονίδια που απαιτούνται για τη σύνθεση του ενζύμου εισάχθηκαν στο γενετικό υλικό ενός ιού, το οποίο είχε επίσης τροποποιηθεί, έτσι ώστε ο ιός να μην μπορεί να πολλαπλασιαστεί. Με τον τρόπο αυτόν, ο ιός χρησιμοποιήθηκε ως «Δούρειος Ίππος» για τη μεταφορά του γονιδίου στο εσωτερικό των κυττάρων.
Η επιστημονική ομάδα του NIH έλαβε δείγματα αίματος από τα δύο κορίτσια και απομόνωσε τα λευκά αιμοσφαίρια, τα οποία ακολούθως «μόλυνε» με τους τροποποιημένους ιούς. Ύστερα, οι επιστήμονες εισήγαγαν και πάλι στα κορίτσια τα νέα λευκά αιμοσφαίρια. Η αγωγή αυτή χορηγήθηκε άλλες 12 φορές σε διάστημα 18-24 μηνών. Αυτή η αγωγή κατάφερε να περιορίσει σημαντικά τα συμπτώματα των κοριτσιών και έδειξε ότι αντίστοιχες προσεγγίσεις είναι ασφαλείς για τους ασθενείς.
Παρ’ όλα αυτά, το 1999 ο 18χρονος Jesse Gelsinger έλαβε μια πειραματική γονιδιακή θεραπεία για ένα μεταβολικό νόσημα του ήπατος, η οποία προκάλεσε υπερβολική ενεργοποίηση του ανοσοποιητικού συστήματος. Λίγα χρόνια αργότερα, το 2003, επιστήμονες ανέφεραν ότι ορισμένοι ασθενείς που έλαβαν γονιδιακές θεραπείες για ανοσοανεπάρκειες παρουσίασαν λευχαιμία, αποτέλεσμα της εισαγωγής γονιδίων του ιού σε περιοχές του γονιδιώματος που συνδέονται με τον καρκίνο.
Αρκετές έρευνες έχουν πραγματοποιηθεί προκειμένου να βρεθούν οι ιοί που έπειτα από συγκεκριμένες τροποποιήσεις κρίνονται κατάλληλοι φορείς για τη μεταφορά και την ενσωμάτωση γονιδίων στο γονιδίωμα του ασθενή. Οι αδενοϊοί, οι οποίοι αποτελούν μια μεγάλη ομάδα ιών που μπορούν να μολύνουν ένα ευρύ φάσμα ζώων, καθώς και τους ανθρώπους, πήραν το όνομά τους από τον ιστό από τον οποίο απομονώθηκαν αρχικά, δηλαδή τις αδενοειδείς εκβλαστήσεις (αμυγδαλές). Αυτοί χρησιμοποιούνται συχνά ως φορείς. Το γενετικό υλικό που μεταφέρουν οι αδενοϊοί στις γονιδιακές θεραπείες δεν ενσωματώνεται στο γονιδίωμα του κυττάρου, αλλά παραμένει στο κυτταρόπλασμα, όπου και μεταφράζεται. Το γεγονός αυτό έχει σχεδόν εξαλείψει τον κίνδυνο καρκίνου στους ασθενείς, αλλά ταυτόχρονα μειώνει τη διάρκεια της θεραπείας, καθώς το γενετικό υλικό παραμένει για ένα συγκεκριμένο χρονικό διάστημα στο κυτταρόπλασμα του κυττάρου-ξενιστή. Παράλληλα, ένα άλλο πλεονέκτημα των αδενοϊών είναι ότι έχουν σχετικά μικρό μέγεθος, γεγονός που τους επιτρέπει να μολύνουν ένα μεγάλο εύρος κυττάρων και να εξαπλώνονται ευκολότερα στους ιστούς.
Ως φορείς χρησιμοποιούνται, επίσης, και οι ρετροϊοί. Οι ρετροϊοί έχουν ένα ένζυμο, την αντίστροφη μεταγραφάση, που μπορεί να συνθέσει DNA χρησιμοποιώντας ως καλούπι το RNA του ιού. Όταν ο ρετροϊός μολύνει το κύτταρο, γίνεται συγχώνευση του μεμβρανώδους φακέλου του με τη μεμβράνη του κυττάρου (ενδοκύττωση). Έτσι, το καψίδιο μαζί με το γονιδίωμα του ιού εισάγεται στο κύτταρο. Οι ρετροϊοί εμφανίζουν διαφορετικά πλεονεκτήματα από τους αδενοιούς. Για παράδειγμα, μπορούν να μεταφέρουν μεγαλύτερες και πιο σύνθετες αλληλουχίες γονιδίων σε σχέση με τους αδενοϊούς, ενώ η διάρκεια παραμονής τους στα κύτταρα είναι μεγαλύτερη, γεγονός που παρατείνει τη θεραπευτική δράση.
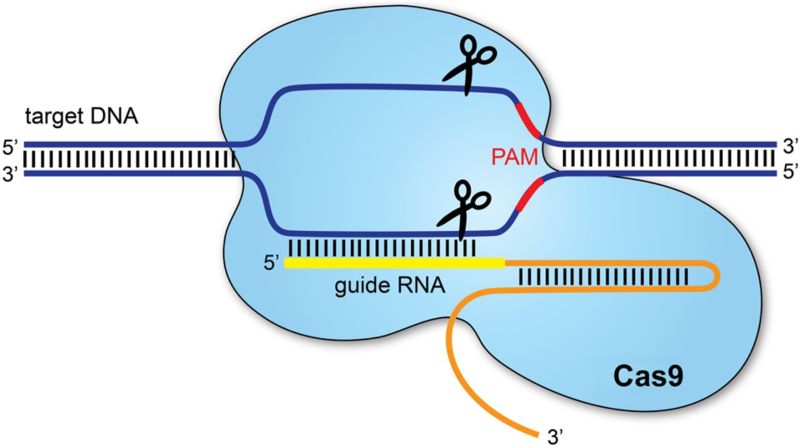
Σήμερα, διάφορες μελέτες εστιάζουν περισσότερο στην επιδιόρθωση ενός ελαττωματικού γονιδίου, παρά στην αντικατάστασή του. Ένα σύγχρονο μοριακό εργαλείο που ακολουθεί αυτή την προσέγγιση γονιδιακής θεραπείας είναι το CRISPR-Cas9. Το CRISPR-Cas9 επεξεργάζεται τα γονίδια κόβοντας με ακρίβεια το DNA και στη συνέχεια αφήνει τους επιδιορθωτικούς μηχανισμούς του DNA (επιδιορθωτικά ένζυμα) να αναλάβουν. Το σύστημα αποτελείται από δύο μέρη: το ένζυμο Cas9 και έναν οδηγό RNA. Δηλαδή, το CRISPR-Cas9 χρησιμοποιεί μια μικρή αλυσίδα RNA για να κατευθύνει το ένζυμο Cas9 σε μια θέση στο γονιδίωμα με παρόμοια αλληλουχία. Στη συνέχεια, το ένζυμο κόβει και τους δύο κλώνους του DNA σε αυτό το σημείο και τα επιδιορθωτικά ένζυμα του κυττάρου επισκευάζουν το χάσμα.
Επομένως, η γονιδιακή θεραπεία, από μια ιδέα η οποία διατυπώθηκε το 1972, πλέον αποτελεί μια πραγματικότητα και είναι ικανή να οδηγήσει στην καταπολέμηση διάφορων γενετικών ασθενειών.
ΕΝΔΕΙΚΤΙΚΕΣ ΠΗΓΕΣ
- Gene Therapy, ncbi.nlm.nih.gov. Διαθέσιμο εδώ
- Gene Therapy Leaves a Vicious Cycle, frontiersin.org. Διαθέσιμο εδώ
- Ιοί, ebooks.edu.gr. Διαθέσιμο εδώ
- How Gene Therapy Can Cure or Treat Diseases, fda.gov. Διαθέσιμο εδώ
- What is gene therapy?, medlineplus.gov. Διαθέσιμο εδώ
- The Return of Gene Therapy, labiotech.eu. Διαθέσιμο εδώ
- CRISPR gene editing in human embryos wreaks chromosomal mayhem, nature.com. Διαθέσιμο εδώ
- CRISPR/Cas9 – a specific, efficient and versatile gene-editing technology we can harness to modify, delete or correct precise regions of our DNA, crisprtx.com. Διαθέσιμο εδώ
- The History and Evolution of Gene Therapy, thegenehome.com. Διαθέσιμο εδώ
- Γονιδιακές Θεραπείες: Το Παρελθόν, το Παρόν και το Μέλλον, pathologia.eu. Διαθέσιμο εδώ