Του Θεόδωρου Δημούδη,
Χιλιάδες χρόνια πριν την ανάπτυξη των επιστημονικών τεχνικών και της επιστήμης της φαρμακολογίας, οι άνθρωποι παρουσίαζαν έντονο ενδιαφέρον για την εύρεση ουσιών που θα παρουσίαζαν κάποια ευεργετική επίδραση και θα είχαν θεραπευτικό αποτέλεσμα. Οι γεμάτοι παράσιτα, ταλαιπωρημένοι από τις αρρώστιες πρόγονοί μας μασούσαν κάθε καινούρια ρίζα και φυτό που συναντούσαν, ελπίζοντας πως θα τους λύτρωνε από τα βάσανά τους. Τα χρόνια μπορεί να πέρασαν, η επιστήμη να εξελίχθηκε. Ωστόσο, η ανάγκη και το ενδιαφέρον του ανθρώπου για την εύρεση θεραπευτικών δραστικών ουσιών παραμένουν αμείωτα. Έτσι, σήμερα στα υπερσύγχρονα εργαστήρια των φαρμακευτικών εταιρειών επιχειρείται η ανακάλυψη και η σύνθεση φαρμακευτικών ουσιών με μια διαδικασία που προκαλεί το ενδιαφέρον όλων μας.
Ο παραδοσιακός τρόπος ανακάλυψης των φαρμάκων ξεκινά από μια αρχική παρατήρηση θεραπευτικής δράσης ενός φυσικού προϊόντος και στη συνέχεια ακολουθούν η απομόνωση της δραστικής ουσίας, η σύνθεσή της και τέλος, η τροποποίηση αυτής, έτσι ώστε να γίνει πιο αποτελεσματική ή/και λιγότερο επιβλαβής. Ωστόσο, ο νέος τρόπος ανακάλυψης ακολουθεί ένα διαφορετικό και αντίστροφο -θα μπορούσε να πει κανείς- μοτίβο. Με βάση την παθοφυσιολογία, δηλαδή τον βιοχημικό μηχανισμό της ασθένειας, σχεδιάζονται μόρια τροποποιητές των μηχανισμών αυτών. Με αυτόν τον τρόπο, σήμερα έχουμε μια νέα γενιά φαρμάκων, τα έξυπνα φάρμακα.
Τα πρώτα στάδια ανακάλυψης φαρμάκων
Τα μόρια που μπορούν να αξιοποιηθούν ως φάρμακα συνήθως ανακαλύπτονται μέσω δύο διαφορετικών προσεγγίσεων. Η μία προσέγγιση, η διαλογή που βασίζεται στον στόχο (target–based screening), προϋποθέτει ότι έχει ήδη ταυτοποιηθεί ένας στόχος, δηλαδή μια πρωτεΐνη ή ένα ολιγονουκλεοτίδιο, του οποίου η δραστικότητα, εάν τροποποιηθεί από ένα φάρμακο, θα αλλάξει την πορεία εξέλιξης κάποιας ασθένειας στον άνθρωπο. Όταν επιβεβαιωθεί ότι ένας στόχος παίζει ρόλο στην εκδήλωση της νόσου, εντοπίζεται ένα μόριο το οποίο προσδένεται ή «προσβάλλει» τον στόχο (υποδοχέα), έτσι ώστε να ανασταλεί η δραστηριότητά του, δηλαδή να τροποποιηθεί η νόσος.
Με υπολογιστικές μεθόδους τελειοποιείται η ενεργός περιοχή πρόσδεσης μορίου και υποδοχέα, ώστε να βελτιωθεί η ασφάλεια και η δραστικότητα του υποψήφιου φαρμάκου. Στη συνέχεια, σε μια τέτοια δοκιμασία ελέγχονται βιβλιοθήκες ενώσεων, προκειμένου να ταυτοποιηθούν μόρια με επιθυμητή φαρμακολογική δράση και να βελτιστοποιηθούν. Οι αλληλεπιδράσεις μεταξύ των φαρμάκων και των στόχων τους, π.χ. των υποδοχέων, των ενζύμων κ.λπ., είναι ιδιαίτερα εξειδικευμένες. Συνήθως για αυτές τις εξειδικευμένες αλληλεπιδράσεις είναι υπεύθυνο ένα μόνο τμήμα του φαρμάκου, του οποίου οι ομάδες αλληλεπιδρούν με τον υποδοχέα και είναι υπεύθυνο για την εκδήλωση της δραστικότητας (φαρμακοφόρο). Ο εντοπισμός του φαρμακοφόρου είναι ιδιαίτερης σημασίας, γιατί καταδεικνύει τις χημικές τροποποιήσεις που πρέπει να γίνουν για τη βελτίωση της δραστικής ένωσης.
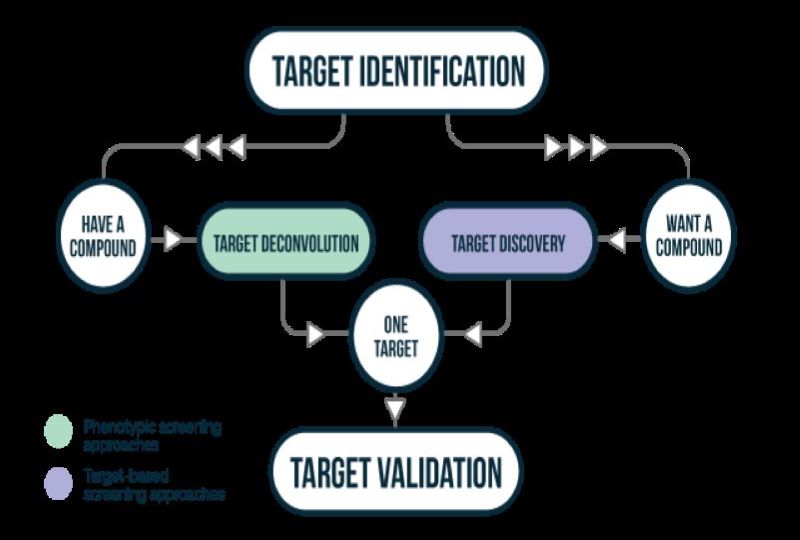
Εναλλακτικά, η άλλη προσέγγιση που ακολουθείται είναι η διαλογή που βασίζεται στον φαινότυπο (phenotypic screening). Σε αυτήν τη μέθοδο, βιβλιοθήκες ενώσεων ελέγχονται μαζικά μέσω μιας δοκιμασίας που έχει σχεδιαστεί για να ανιχνεύει έναν επιθυμητό φαινότυπο σε ένα κυτταρικό σύστημα ή ένα ζωικό μοντέλο. Για παράδειγμα, ελέγχονται ενώσεις ως προς την ικανότητά τους να προάγουν την κυτταρική επιβίωση ή να αναστέλλουν το ανοσοποιητικό σύστημα, χωρίς να έχει αναγνωριστεί ο στόχος. Έπειτα, μέσω ενδελεχών αναλύσεων ελέγχεται ο μηχανισμός δράσης, ταυτοποιείται ο υποδοχέας και κρίνεται το αν μπορούν να βελτιστοποιηθούν σε υποψήφια φάρμακα.
Κλινικές δοκιμές φαρμάκων
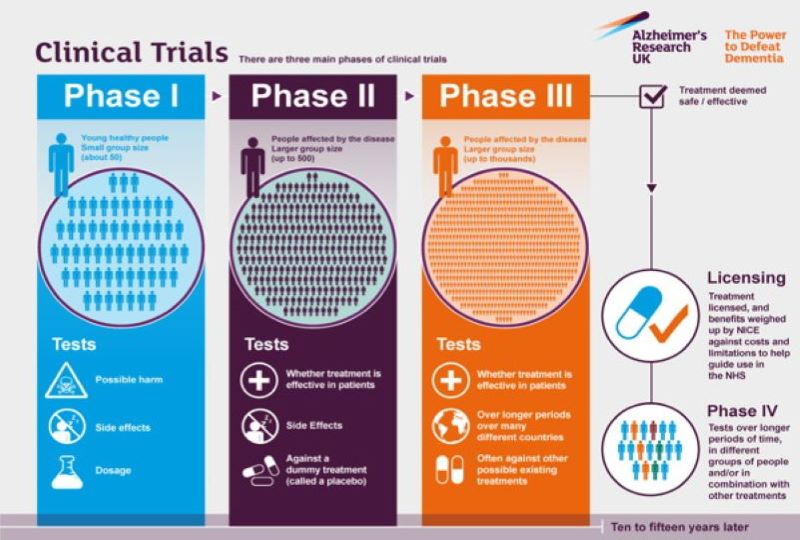
Αφού ανακαλυφθεί η ουσία που έχει φαρμακευτική δράση, τότε πρέπει να μελετηθεί ως προς τρία κύρια χαρακτηριστικά: την αποτελεσματικότητα, την ασφάλεια και την ποιότητα. Αυτές οι πρώτες μελέτες πραγματοποιούνται στο εργαστήριο, χρησιμοποιώντας καλλιέργειες κυττάρων και ζώα, ερευνώντας τις βιολογικές και χημικές ιδιότητες αυτής της ουσίας — πώς απορροφάται, κατανέμεται και απομακρύνεται από το σώμα – καθώς και την ασφάλειά της.
Εάν η νέα ουσία είναι ασφαλής και αποτελεσματική σε ζώα, η επόμενη φάση πραγματοποιεί δοκιμές σε έναν μικρό αριθμό υγιών ανθρώπων εθελοντών, για να επιβεβαιώσουν τις πληροφορίες από τις μελέτες σε ζώα και να αποκτήσουν περαιτέρω πληροφορίες σχετικά με τις επιπτώσεις της ουσίας και την ασφαλή δοσολογία (Φάση Ι). Έπειτα, η ουσία χορηγείται σε έναν μικρό αριθμό πασχόντων για να διερευνηθεί η δραστικότητα και οι παρενέργειες (Φάση ΙΙ) και αφού ολοκληρωθεί και αυτό το στάδιο, χορηγείται σε μια μεγάλη μερίδα ασθενών, ώστε να παρακολουθηθούν οι αντιδράσεις σε μακροχρόνια χρήση (Φάση ΙΙΙ). Τα αποτελέσματα όλων των προκλινικών και κλινικών μελετών μαζί με την περιγραφή της διαδικασίας παραγωγής υποβάλλονται στις Ρυθμιστικές Αρχές. Εφόσον τα δεδομένα αποδεικνύουν την ασφάλεια, την αποτελεσματικότητα και την ποιότητα, τότε χορηγείται άδεια κυκλοφορίας και το φάρμακο μπορεί να διατεθεί στην αγορά. Παράλληλα όμως, διεξάγονται μετεγκριτικές μελέτες (Φάση ΙV) στις οποίες καταγράφονται πληροφορίες από την καθημερινή κλινική χρήση των φαρμάκων, αξιολογούνται τα μακροπρόθεσμα αποτελέσματά τους και οι σπάνιες αλλά δυνητικά σοβαρές ανεπιθύμητες ενέργειες.
Προβλήματα κατά την ανάπτυξη φαρμάκων
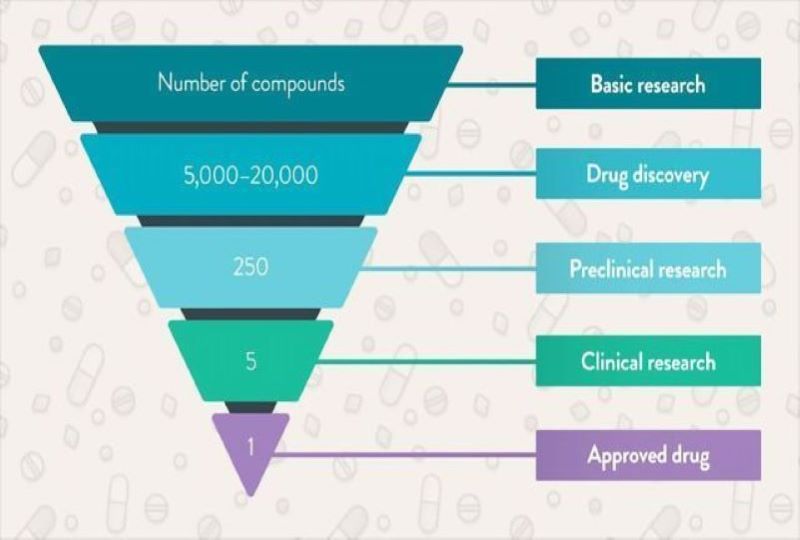
Είναι γεγονός πως οι εταιρείες φαρμάκων αναλαμβάνουν ένα πολύ μεγάλο ρίσκο κατά την παραγωγή ενός νέου φαρμάκου. Για παράδειγμα, μόνο μία από τις 10.000 ενώσεις που ανακαλύπτονται γίνεται πραγματικά ένα εγκεκριμένο φάρμακο προς πώληση, ενώ έχει υπολογιστεί από κάποιους χημικούς ότι ο συνολικός αριθμός των πιθανών φαρμακευτικών ενώσεων στο σύμπαν μας είναι 3×1062! Με άλλα λόγια δηλαδή, αν δοκιμάζαμε χίλιες ενώσεις το δευτερόλεπτο, αναζητώντας εκείνη που θα θεράπευε μία ασθένεια, μέχρι να σβήσει ο ήλιος μας δε θα καταφέρναμε να τις δοκιμάσουμε όλες. Επιπροσθέτως, χρειάζονται περίπου 7-10 χρόνια και ένα κόστος από 500 εκατ. έως και 2 δις ευρώ συνολικά για την ανάπτυξη κάθε νέου φαρμάκου, τα οποία δαπανώνται πριν οι ρυθμιστικές αρχές εγκρίνουν το φάρμακο. Αυτό πρακτικά σημαίνει πως εάν το φάρμακο δεν εγκριθεί, η εταιρεία χάνει τα χρήματα.
Ένα άλλο ακόμα εμπόδιο στην κυκλοφορία ενός φαρμάκου είναι οι ανεπιθύμητες ενέργειες. Οι υποδοχείς και τα ένζυμα είναι συνήθως παρόντα σε πολλά διαφορετικά συστήματα ιστών. Στοχεύοντας, λοιπόν, έναν συγκεκριμένο στόχο, είναι πιθανόν ένα φάρμακο να δράσει θεραπευτικά σε μια περιοχή ιστών που σχετίζεται με την ασθένεια αλλά να προκαλέσει ανεπιθύμητη δραστικότητα σε άλλες περιοχές ιστών. Επομένως, πρέπει να βρεθεί η ισορροπία μεταξύ του οφέλους και του κινδύνου από την κυκλοφορία ενός φαρμάκου, τα οποία μπορεί να προκαλούν είτε άμεσο είτε μακροπρόθεσμο κίνδυνο, ο οποίος μπορεί να είναι μεγαλύτερος για κάποιους ασθενείς (λόγω ηλικίας, DNA, κ.λπ.). Μάλιστα, όσον αφορά το τελευταίο, το γονιδίωμα κάθε ανθρώπου είναι μοναδικό, πράγμα που μπορεί να επηρεάζει τη δράση του φαρμάκου και να το καθιστά λιγότερο κατάλληλο για αυτόν. Αυτή είναι και η αφορμή της ανάπτυξης του κλάδου της φαρμακογονιδιωματικής.
Τέλος, παρόλο που η ανακάλυψη φαρμάκων είναι κυρίως το αποτέλεσμα συστηματικών μελετών και έρευνας, καθοριστικός είναι και ο παράγοντας τύχη. Πολλά φάρμακα έχουν ανακαλυφθεί από μια τυχαία παρατήρηση. Το αντιβιοτικό πενικιλίνη, για παράδειγμα, παράγεται από έναν μύκητα, ο οποίος συμπτωματικά μόλυνε ένα τρυβλίο καλλιέργειας, σκοτώνοντας τα παραπλήσια βακτήρια. Επίσης, φάρμακα όπως η χλωροπρομαζίνη και η σιλδεναφίλη (Viagra) είχαν διαφορετικά αποτελέσματα στη φυσιολογία του ανθρώπου από αυτά που αναμένονταν, ενώ και οι βενζοδιαζεπίνες (Xanax) ανακαλύφθηκαν τυχαία στην προσπάθεια ανάπτυξης νέων χρωστικών. Συνεπώς, είναι σημαντικό να υπάρχει παρατηρητικότητα και υπομονή, αφού πολλές ουσίες μπορεί να φαίνονται αποτυχημένες για τον σκοπό που δοκιμάζονται, αλλά να δίνουν θεραπευτικές λύσεις σε άλλες περιστάσεις.
ΕΝΔΕΙΚΤΙΚΕΣ ΠΗΓΕΣ
- Κόκοτος, Γ., & Μαγκριώτη, Β. (2015), Ανακάλυψη, Σχεδιασμός και Ανάπτυξη Φαρμάκων, Κάλλιπος, Ανοικτές Ακαδημαϊκές Εκδόσεις. Διαθέσιμο εδώ
- Δ. Κουρέτας, Διάλεξη: Τοξικολογία και Φάρμακα, μάθημα: Βιοχημική Τοξικολογία, Τμήμα Βιοχημείας και Βιοτεχνολογίας, Πανεπιστήμιο Θεσσαλίας. Διαθέσιμο εδώ
- Ανακάλυψη νέων φαρμάκων, Novartis.gr. Διαθέσιμο εδώ
- Donald R. Kirsch, Ogi Ogas, The Drug Hunters: The Improbable Quest to Discover New Medicines, Arcade, 2016
- Berg, J., Tymoczko, J., Gatto, G.J., Stryer, L., Βιοχημεία, Πανεπιστημιακές Εκδόσεις Κρήτης, 2021




