Της Μαρίας Δήμα,
Οι νευροεκφυλιστικές νόσοι, όπως η νόσος του Alzheimer, η νόσος του Parkinson και η πλάγια αμυοτροφική σκλήρυνση (ALS), χαρακτηρίζονται από προοδευτική απώλεια συγκεκριμένων νευρωνικών πληθυσμών, διαταραχή στη συναπτική επικοινωνία και συσσώρευση παθολογικών πρωτεϊνών. Παρόλο που έχουν ταυτοποιηθεί γενετικοί και περιβαλλοντικοί παράγοντες, η παθογένεια των νόσων αυτών παραμένει εν μέρει αδιευκρίνιστη, με αποτέλεσμα την αδυναμία ανάπτυξης αποτελεσματικών θεραπειών. Ένα από τα μεγαλύτερα εμπόδια είναι η περιορισμένη αντιπροσωπευτικότητα των ζωικών μοντέλων ως προς την ανθρώπινη παθολογία. Τα τελευταία χρόνια, η ανάπτυξη τρισδιάστατων ανθρωπίνων εγκεφαλικών μοντέλων, όπως τα οργανοειδή εγκεφάλου και τα μοντέλα εγκεφάλου-σε-τσιπ (brain-on-a-chip), έχουν αναδείξει νέες δυνατότητες στη μελέτη των νευροεκφυλιστικών νοσημάτων.
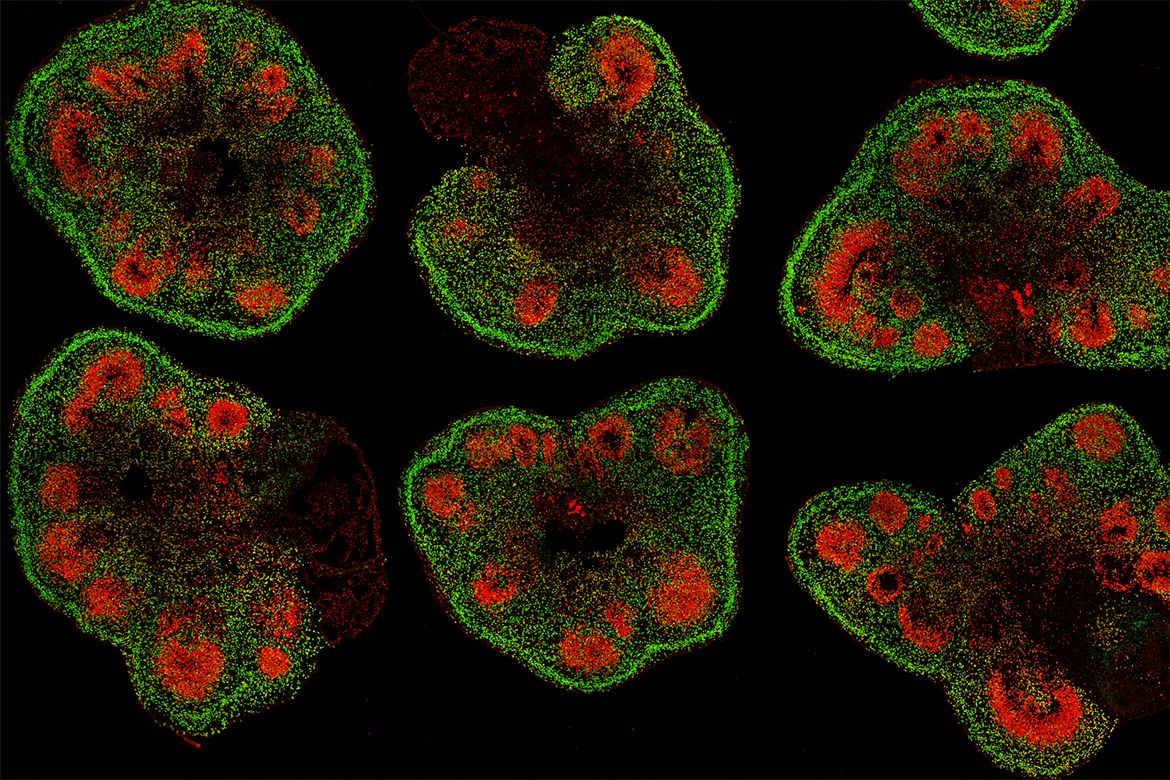
Τα οργανοειδή εγκεφάλου προκύπτουν από ανθρώπινα επαγόμενα πολυδύναμα βλαστοκύτταρα (hiPSCs) ή εμβρυϊκά βλαστοκύτταρα (hESCs), τα οποία, μέσω καθοδηγούμενης διαφοροποίησης, αυτοοργανώνονται σε τρισδιάστατες κυτταρικές δομές, που μιμούνται την αρχιτεκτονική και την κυτταρική ποικιλομορφία του ανθρώπινου εγκεφάλου. Περιλαμβάνουν κυρίως νευρώνες, αστροκύτταρα και ολιγοδενδροκύτταρα, ενώ μπορούν να περιλαμβάνουν ακόμη και πρόδρομες μορφές μικρογλοιακών κυττάρων ή να τροποποιηθούν ώστε να φέρουν συγκεκριμένες γενετικές μεταλλάξεις. Μπορούν επίσης να κατευθυνθούν προς συγκεκριμένες περιοχές, όπως ο φλοιός, ο μεσεγκέφαλος και ο υποθάλαμος, ανάλογα με τα σήματα διαφοροποίησης που εφαρμόζονται (π.χ. μέσω των μορίων SHH, FGF8, WNT3a).
Αυτές οι δομές επιτρέπουν τη μελέτη της εγκεφαλικής ανάπτυξης, της οργανογένεσης, αλλά και της παθοφυσιολογίας σε κυτταρικό επίπεδο. Επιπλέον, συνιστούν ένα πλαίσιο για τη μελέτη μηχανισμών όπως οι πρωτεϊνοπάθειες, η αυτοφαγία, η μιτοχονδριακή δυσλειτουργία και η απορρύθμιση του RNA μεταβολισμού, τα οποία εμπλέκονται σε πολλές νευροεκφυλιστικές νόσους.
Στη νόσο του Alzheimer, τα οργανοειδή έχουν χρησιμοποιηθεί για την αναπαράσταση της συσσώρευσης του πεπτιδίου β-αμυλοειδούς (Aβ42), την υπερφωσφορυλίωση της πρωτεΐνης Tau και τη συναπτική απώλεια. Επιπλέον, έχουν καταγραφεί μεταβολές στο σηματοδοτικό μονοπάτι GSK-3β καθώς και ενεργοποίηση μικρογλοιακών στοιχείων, μέσω φλεγμονωδών διεργασιών, προσομοιώνοντας σε ικανοποιητικό βαθμό την πρώιμη παθολογία. Μελέτες έχουν δείξει επίσης αυξημένα επίπεδα ROS (Reactive Oxygen Species – Δραστικές Ρίζες Οξυγόνου) και μείωση της δραστικότητας ενζύμων όπως το SOD1, που συνδέονται με οξειδωτικό στρες.
Στη νόσο του Parkinson, οργανοειδή εμπλουτισμένα με ντοπαμινεργικούς νευρώνες από ασθενείς με μεταλλάξεις στα γονίδια SNCA, LRRK2 και PARK2 παρουσιάζουν χαρακτηριστικά, όπως σωμάτια Lewy (λόγω της συσσωρευμένης πρωτεΐνης α-συνουκλεΐνης), διαταραχές στην αυτοφαγία, και μιτοχονδριακή αποδιοργάνωση. Η επαγωγή της παθολογίας σε υγιή οργανοειδή μέσω εξωγενούς χορήγησης α-συνουκλεΐνης αποδεικνύει τη δυνατότητα μελέτης μηχανισμών “seeding” και πρωτεϊνικής μετάδοσης.
Στην πλάγια αμυοτροφική σκλήρυνση (ALS), έχουν δημιουργηθεί οργανοειδή από iPSCs ασθενών με μεταλλάξεις στα γονίδια SOD1, FUS και C9orf72. Σε αυτά, παρατηρείται εκφυλισμός κινητικών νευρώνων, συσσώρευση της πρωτεΐνης TDP-43, και δυσλειτουργία στην επεξεργασία του RNA και στην αξοπλασματική μεταφορά. Σημαντικά ευρήματα αφορούν τη διαταραχή των stress granules, των πυρηνικών σωμάτων που εμπλέκονται στη ρύθμιση της μετάφρασης και της απόκρισης στο στρες. Η συν-καλλιέργεια με αστροκύτταρα και μικρογλοιακά κύτταρα αποκάλυψε επίσης σημαντικό ρόλο της κυτταρικής τοξικότητας μέσω της γλοιακής φλεγμονής και της έκκρισης προ-φλεγμονωδών κυτοκινών όπως IL-1β και TNF-α.
Από την άλλη πλευρά, τα μοντέλα brain-on-a-chip αποτελούν ένα σύστημα μικρορευστοειδών, στο οποίο νευρικά κύτταρα αναπτύσσονται μέσα σε τρισδιάστατα κανάλια με ενσωματωμένους αισθητήρες για τη μέτρηση της ηλεκτρικής δραστηριότητας, της οξυγόνωσης ή άλλων μεταβολικών παραμέτρων. Ένα από τα σημαντικότερα πλεονεκτήματα τους είναι η δυνατότητα μοντελοποίησης του αιματοεγκεφαλικού φραγμού (BBB) με μεγάλη ακρίβεια. Ενδοθηλιακά κύτταρα, περικύτταρα, αστροκύτταρα και βασική μεμβράνη αναπαράγονται λειτουργικά, επιτρέποντας τη μελέτη της διαπερατότητας, της φλεγμονώδους απόκρισης και της τοξικότητας φαρμάκων.
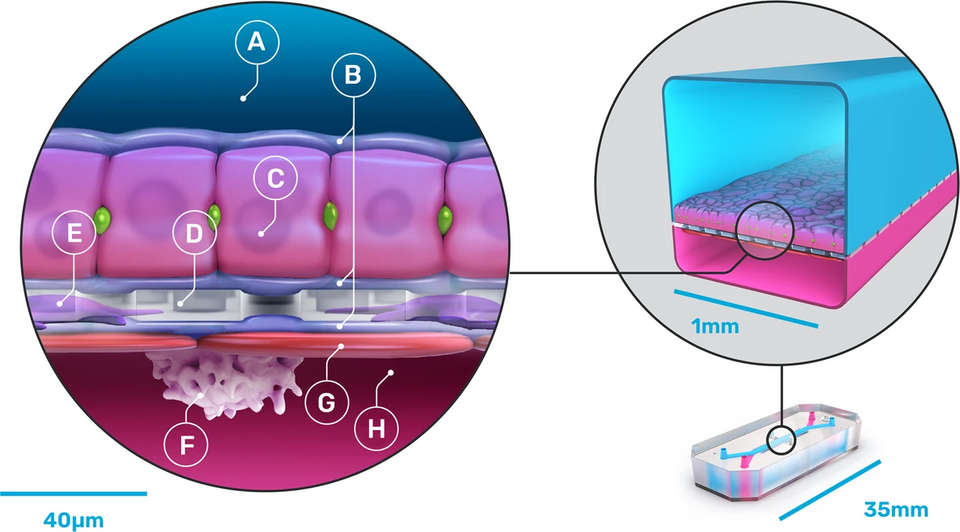
Τα μοντέλα αυτά επιτρέπουν τη χωρική απομόνωση και λειτουργική σύνδεση διαφόρων περιοχών του ΚΝΣ, όπως ο φλοιός και ο νωτιαίος μυελός, μέσω αξονικής επέκτασης. Έτσι, καθίσταται δυνατή η παρακολούθηση εκφυλιστικών φαινομένων όπως η απώλεια συναπτικής σύνδεσης, η νευραξονική καταστροφή και οι μηχανισμοί Wallerian degeneration (εκφυλισμός Wallerian – μοτίβο βλάβης στις νευρικές ίνες όπου ο άξονας ενός νεύρου καταρρέει εξαιτίας μιας βλάβης που καταστρέφει τον πυρήνα), που σχετίζονται με την ALS και άλλες κινητικές νευροπάθειες.
Σημαντική είναι και η συμβολή τους στην εξατομικευμένη ιατρική. Με τη χρήση iPSCs από συγκεκριμένους ασθενείς, είναι δυνατό να δημιουργηθούν “ασθενειο-ειδικά” μοντέλα, επιτρέποντας τον in vitro έλεγχο της αποτελεσματικότητας φαρμάκων ή γονιδιακών θεραπειών. Επιπλέον, επιτρέπουν τη δοκιμή φαρμάκων σε μεγάλη κλίμακα (high-throughput screening), με ταυτόχρονη καταγραφή πολυπαραμετρικών δεδομένων, όπως κυτταρική βιωσιμότητα, μεταβολική δραστηριότητα και μεταγραφικά προφίλ.
Ωστόσο, τα μοντέλα αυτά δεν στερούνται περιορισμών. Τα οργανοειδή στερούνται αγγείωσης και παρουσιάζουν περιορισμένη ωρίμανση και πολυπλοκότητα. Επιπλέον, το μέγεθός τους και η αδυναμία ελεγχόμενης τοπογραφίας μπορεί να επηρεάσει την ομοιομορφία των αποτελεσμάτων. Από την άλλη πλευρά, τα μοντέλα brain-on-a-chip απαιτούν εξειδικευμένες τεχνικές μικρομηχανικής και υψηλό επίπεδο τεχνικής επανάληψης, ενώ ενίοτε παρουσιάζουν αστάθεια στις μακροχρόνιες καλλιέργειες.
Συμπερασματικά, η χρήση εγκεφαλικών οργανοειδών και brain-on-a-chip μοντέλων αποτελεί επαναστατική πρόοδο στη μελέτη της παθοφυσιολογίας των νευροεκφυλιστικών νόσων. Με την ικανότητά τους να προσομοιώνουν με υψηλή ακρίβεια το ανθρώπινο μικροπεριβάλλον, να ενσωματώνουν γενετικές ιδιαιτερότητες και να εφαρμόζονται σε δυναμικά in vitro συστήματα, αποτελούν πολύτιμα εργαλεία για την αποκρυπτογράφηση της νευρωνικής εκφύλισης και τη δημιουργία νέων θεραπευτικών προσεγγίσεων, ενισχύοντας την ελπίδα για την ανάπτυξη σύγχρονων στοχευμένων θεραπειών.
ΕΝΔΕΙΚΤΙΚΕΣ ΠΗΓΕΣ
- Organoids: A new window into disease, development and discovery, HSC, διαθέσιμο εδώ
- Organoids: The current status and biomedical applications, MedComm, διαθέσιμο εδώ
- Clinical applications of human organoids, Nature Medicine, διαθέσιμο εδώ
- Organ-on-a-Chip Models of the Blood-Brain Barrier: Recent Advances and Future Prospects, Small, διαθέσιμο εδώ
- Unraveling brain diseases: The promise of brain-on-a-chip models, Journal of Neuroscience Methods, διαθέσιμο εδώ